Regulatorische T-Zellen verhindern, dass das Immunsystem den eigenen Körper angreift. Mary E. Brunkow, Fred Ramsdell und Shimon Sakaguchi erhalten dafür den Nobelpreis 2025. Ihre Entdeckungen zur peripheren Immuntoleranz haben große Bedeutung für Autoimmunerkrankungen, die sich in der Schwangerschaft verändern können. Zudem ermöglichen sie neue Krebstherapien. Checkpoint-Inhibitoren und Treg-gerichtete Ansätze befinden sich in klinischen Prüfungen und bieten neue Behandlungsoptionen in der Onkologie.
Verleihung an Forschende aus Japan und den USA
Mary E. Brunkow: Geboren 1961. Promotion an der Princeton University, Princeton, USA. Senior Program Manager am Institute for Systems Biology, Seattle, USA.
Fred Ramsdell: Geboren 1960. Promotion 1987 an der University of California, Los Angeles, USA. Scientific Advisor bei Sonoma Biotherapeutics, San Francisco, USA.
Shimon Sakaguchi: Geboren 1951. Medizinstudium 1976 und Promotion 1983 an der Kyoto University, Japan. Distinguished Professor am Immunology Frontier Research Center, Osaka University, Japan.
Mary E. Brunkow vom Institute for Systems Biology in Seattle, Fred Ramsdell von Sonoma Biotherapeutics in San Francisco und Shimon Sakaguchi von der Osaka University erhalten den Nobelpreis für Physiologie oder Medizin 2025. Die Nobel-Versammlung am Karolinska Institute würdigt ihre bahnbrechenden Entdeckungen zur peripheren Immuntoleranz.
Regulatorische T-Zellen kontrollieren das Immunsystem
Das Immunsystem schützt den Körper täglich vor Tausenden verschiedener Mikroben. Gleichzeitig muss es verhindern, dass es körpereigene Strukturen angreift. Die drei Forschenden identifizierten die regulatorischen T-Zellen (Tregs), die verhindern, dass das Immunzellen sich gegen den eigenen Organismus richtet.
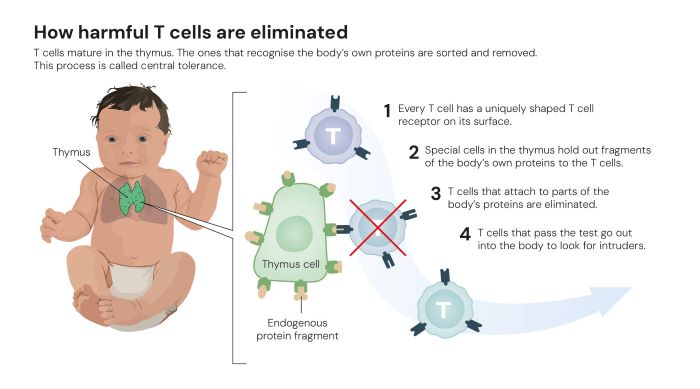
Shimon Sakaguchi machte diesbezüglich 1995 die erste essenzielle Entdeckung. Damals waren viele Forschende überzeugt, dass Immuntoleranz ausschließlich durch die sogenannte „zentrale Toleranz“ (Abb. 1) im Thymus entsteht. Sakaguchi bewies, dass das Immunsystem komplexer funktioniert. Er entdeckte eine bis dahin unbekannte Klasse von Immunzellen, die den Körper vor Autoimmunerkrankungen schützen.
Shimon Sakaguchi machte diesbezüglich 1995 die erste essenzielle Entdeckung. Damals waren viele Forschende überzeugt, dass Immuntoleranz ausschließlich durch die sogenannte „zentrale Toleranz“ (Abb. 1) im Thymus entsteht. Sakaguchi bewies, dass das Immunsystem komplexer funktioniert. Er entdeckte eine bis dahin unbekannte Klasse von Immunzellen, die den Körper vor Autoimmunerkrankungen schützen.
Mary Brunkow und Fred Ramsdell lieferten 2001 die zweite relevante Entdeckung zum Thema. Sie konnten anhand ihrer Forschung erklären, warum ein bestimmter Mausstamm besonders anfällig für Autoimmunerkrankungen ist. Die Forschenden entdeckten eine Mutation im Foxp3-Gen. Mutationen im menschlichen Äquivalent dieses Gens verursachen die schwere Autoimmunerkrankung IPEX.
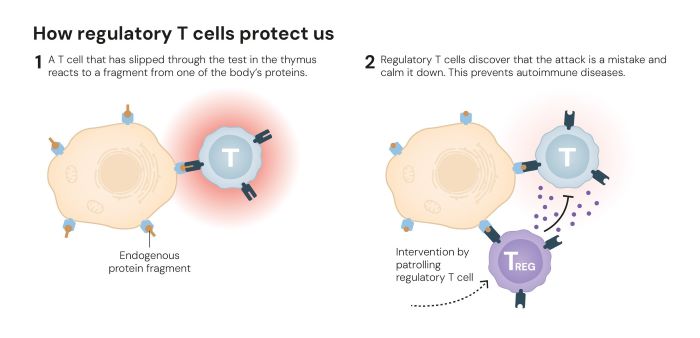
Bereits zwei Jahre später verknüpfte Sakaguchi beide Entdeckungen erfolgreich miteinander. Er bewies, dass das Foxp3-Gen die Entwicklung der 1995 identifizierten Zellen steuert. Die regulatorischen Tregs „überwachen“ andere Immunzellen und sorgen dafür, dass das Immunsystem körpereigenes Gewebe toleriert (Abb. 2).
Bedeutung für Autoimmunerkrankungen und Schwangerschaft
Die mit dem Nobelpreis gewürdigte Forschung legte den Grundstein für das Verständnis der sog. peripheren Toleranz.
Dies hat beispielsweise große Relevanz für Autoimmunerkrankungen, die Frauen bekanntlich häufiger betreffen als Männer. Interessanterweise bessern sich manche Autoimmunerkrankungen während der Schwangerschaft, während andere sich verschlechtern. Regulatorische T-Zellen spielen dabei eine zentrale Rolle, da sie die mütterliche Immuntoleranz gegenüber dem Fötus ermöglichen.
Neue Therapieansätze in der Onkologie
Viele Treg-gerichtete Krebsansätze befinden sich in klinischen Prüfungen oder präklinischen Stadien. Bereits etabliert sind Checkpoint-Inhibitoren sowie ausgewählte Antikörper, die Tregs beeinflussen und häufig in Kombinationen eingesetzt werden.
Checkpoint-Inhibitoren und regulatorische T-Zellen
Checkpoint-Inhibitoren blockieren immunsuppressive Kontrollpunkte wie PD-1/PD-L1 oder CTLA-4. Tumorzellen nutzen diese Mechanismen zur Immunevasion und hemmen tumorinfiltrierende T-Zellen. Anti-PD-1/PD-L1- und Anti-CTLA-4-Antikörper reaktivieren die antitumorale T-Zell-Antwort.
In der gynäkologischen Onkologie zeigen Checkpoint-Inhibitoren bei mehreren Entitäten klinische Relevanz. So beispielsweise beim Endometriumkarzinom und beim rezidivierten oder platinresistenten Ovarialkarzinom.
Immunassoziierte Nebenwirkungen wie Kolitis, Hepatitis oder Endokrinopathien erfordern im Rahmen der Therapie ein interdisziplinäres Management.
KI-gestützt, redaktionell bearbeitet nh
Quelle: Pressemitteilung der Nobel Prize Organisation vom 06.10.2025: They discovered how the immune system is kept in check.
Weiterlesen:



