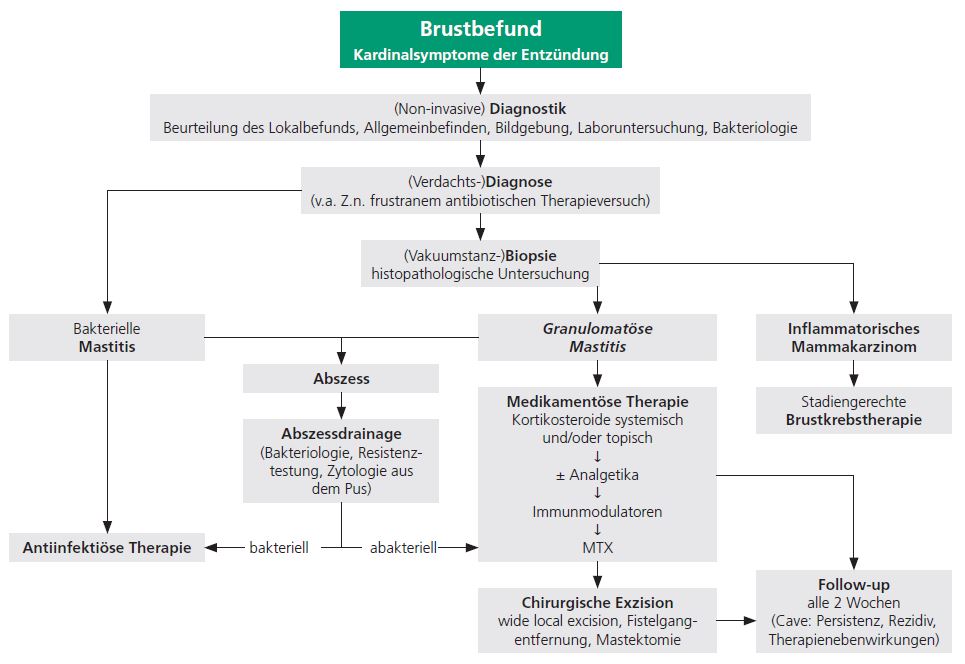
Einleitung
Entzündliche Brusterkrankungen können zu fast allen Zeiten im Leben einer Frau auftreten. Da sich klinisch ein häufig ähnliches Erscheinungsbild präsentiert, sind (differenzial-)diagnostische Abgrenzungen mitunter schwierig (▶ Tab. 1). Dies umso mehr, als in der Regel alle fünf Kardinalsymptome der Entzündung gleichzeitig erfüllt werden (▶ Tab. 2) [1]. Eine möglichst treffsichere ätiopathogenetische Einordnung der verschiedenen Formen inflammatorischer Zustände der weiblichen Brust ist dabei allerdings deshalb wünschenswert, da sich nur daraus ein substanzieller Wegweisungscharakter für Verlauf, Behandlung und Prognose ableiten lässt (▶ Tab. 3) [2].
![Tab. 1 Tab. 1: Inflammatorisches Erscheinungsbild der weiblichen Brust – Was steckt dahinter
[17–22]?](https://gyne.de/wp-content/uploads/sites/2/2025/08/Tab.-1.jpg)
[17–22]?
Granulomatöse Mastitis
Unter dem Krankheitsbild der granulomatösen Mastitis ist eine nonpuerperale, abakterielle, benigne Entzündungsform des Brustgewebes zu verstehen. Von der insgesamt nicht zu den häufigsten Mastitiden zählenden Erkrankung (0,02–3,7 ‰, relativ 2 % aller Brustentzündungen) sind vor allem junge Frauen im gebärfähigen Alter (median 30. Lebensjahr) betroffen. Geburten und Stillperioden steigern das Risiko (Häufigkeitsgipfel etwa zwei Jahre post partum). Erkrankungstypische Gewebeveränderungen kommen dabei im Bereich der Läppchen und des Milchgangsystems vor und wurden als eigenständiges Krankheitsbild erstmalig 1972 von Kessler und Wolloch beschrieben [3].
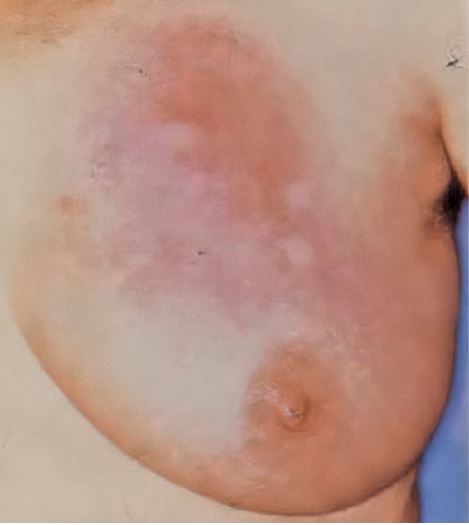
Mastitis. Klinischer Befund der linken
Brust mit multizentrischer, quadrantenübergreifender,
teils konfluierender
Hautrötung, kombiniert mit multiplen
kutanen Indurationen über intramammärer
Knotenbildung.
Klinisch präsentiert sich die Erkrankung mit lokalen Inflammationszeichen inklusive Hautveränderungen und tumorösen Infiltraten (▶ Abb. 1) [4]. Sterile Abszesse, teils mit oberflächlichen Nekrosen und Ulzerationen, mitunter gefolgt von Fistelbildungen, bestimmen Symptomatik und Verlauf. Dieser entwickelt sich bei hoher Rezidivrate oft chronisch [5]. Eine widerspruchsfreie Diagnose ist in jedem Fall durch histopathologische Beurteilung zu sichern, da sowohl das klinische Erscheinungsbild als auch die bildgebende Befundung alternative Erkrankungsursachen (z. B. Malignome) zulassen [6]. Das Vorkommen der granulomatösen Mastitis als puerperale Verlaufsform und als Brustentzündung beim Mann sind möglich, stellen aber Raritäten dar [7].
Die aktuell diskutierten ätiopathogenetischen Modelle der granulomatösen Mastitis sind nach wie vor als vornehmlich hypothetisch anzusehen. Diese listen autoimmunologische, infektiöse, mechanische und endokrine Faktoren als potenziell kausal auf. Im Einzelnen wirkt sich begünstigend aus:
- Autoimmunreaktion auf dem Boden epithelialer Gewebeschäden
- Hyperprolaktinämie (Duktektasie, Milchstau)
- α1-Antitrypsin-Defekt
- Trauma (exogen bedingte Läsion)
- Infektion mit Corynebacterium kroppenstedtii
- Pannikulitis
- Erythema nodosum
- Arthritis
- Nicht-kaukasische Ethnie
- Medikamenteneinnahme (Antidepressiva)
Die granulomatöse Brustentzündung entwickelt sich und verläuft charakteristischerweise über lange Zeit symptomarm [8]. Daraus resultiert vielfach substanzielle Latenz (viele Monate bis Jahre) zwischen den ersten Symptomen und der final korrekten Diagnose. Klinisch manifestiert sich diese spezielle Mastitisform durch eine sukzessive erkennbare variable Kombination lokaler und systemischer Befunde:
- inflammatorisch-erythematöse Hautveränderung(en) (12–50 %)
- (variabel) schmerzhafte, meist unilaterale tastbare Knotenbildung(en) (26–82 %)
- retroareoläre Lokalisation ggf. mit Mamillenretraktion
- (rezidivierende) Abszedierung (37 %), gegebenenfalls mit Ulzeration (18 %)
- Fistelbildung
- axillare Lymphadenopathie (15 %)
- häufige, hartnäckige Rezidive innerhalb von Monaten (50 %)
- Z. n. frustraner Antibiotikatherapie
- keine Körpertemperaturerhöhung
- kein Erreger-, Malignitätsnachweis
![Tab. 3 Tab. 3: Klassifikation und Häufigkeit non-puerperaler Brustentzündungen [23].](https://gyne.de/wp-content/uploads/sites/2/2025/08/Tab.-3.jpg)
Die unspezifische Klinik des Lokalbefunds wie auch der protrahierte Verlauf erschweren und verzögern die Diagnose. Praktisch herausragender Hinweischarakter kommt der Persistenz von Entzündungserscheinungen trotz antibiotischer Therapie (57–100 %) gemeinsam mit einem misslungenen Keimnachweis (Abstrich, Abszessinhalt) und dem Ausschluss einer onkologischen Genese (Zytologie, Histologie) zu. Neben dem klinischen Erscheinungsbild ebnen anamnestische, apparative und laborchemische Parameter den Pfad zur Verdachtsdiagnose „granulomatöse Mastitis“, welche letztlich ausschließlich feingeweblich bewiesen werden kann. Als diagnostische Wegmarken mit Impulscharakter haben die Inhalte von ▶ Tabelle 4 zu gelten.
Galaktostatische, destruierende Verlaufsform
Als Folge einer zugrundliegenden Hyperprolaktinämie resultiert bei der galaktostatischen, destruierenden Verlaufsform der granulomatösen Mastitis die sekretorisch-alveoläre Transformation der Drüsenläppchen. Ihr Auftreten ist bevorzugt im mittleren Lebensalter zu erwarten (Häufigkeitsgipfel median 47 Jahre, Streuung 31–70 Jahre). Makroskopisch finden sich erweiterte, von eingedicktem Sekret verstopfte Milchgänge, sterile Abszesse oder von Detritus erfüllte Kavernen. Mikroskopisch imponiert eine retentionsbedingte, zunächst rein intraduktale Galaktophoritis. Erst infolge einer Ruptur der Milchgangstrukturen breitet sich die Entzündung auf das Brustdrüsenstroma aus. Aus den ins Gewebe übergetretenen Lipidkomponenten des Sekrets entwickeln sich epitheloidzellige und riesenzellhaltige periduktale Granulome. Es ist daher von einem Retentionssyndrom auszugehen, das in der pathophysiologischen Abfolge von Sekretstau, über eine Drüsengangektasie bis hin zur Galaktophoritis, dem chronischen Verlauf dieser Form der granulomatösen Brustentzündung zugrunde liegt. Als Risikofaktoren beziehungsweise Promotoren kommen hochdosierte Östrogen-Gestagen-Therapien, Psychopharmaka, Schilddrüsendysfunktion oder auch Mikroprolaktinome in Frage.
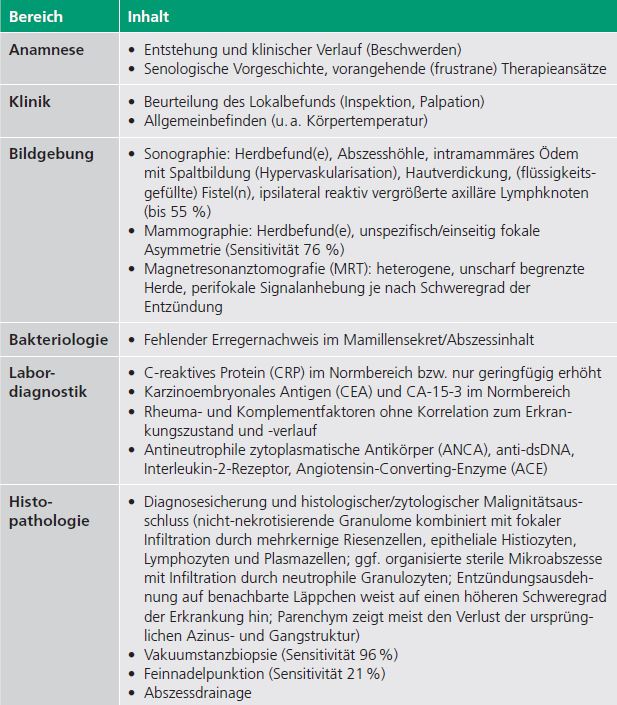
Verdachtsdiagnose „granulomatöse Mastitis“ herangezogen werden können.
Lobuläre granulomatöse Mastitis
Als weniger gewebedestruierend betrifft die lobuläre granulomatöse Mastitis bevorzugt Frauen zwischen dem 30. und 50. Lebensjahr, typischerweise wenige Jahre nach ihrer letzten Entbindung. Histologisch ist diese Mastitisform durch eine chronische, granulomatöse Entzündung mit Riesenzellen und leukozytären Infiltraten gekennzeichnet. Pathogenetisch ist sie noch weitgehend ungeklärt. Diese Erscheinungen sind auf die Läppchen begrenzt und nicht mit Gangektasien oder Sekretretention verbunden.
Über akute Entzündungsphasen kommt es bei dieser zum Teil bilateral auftretenden knotigen Verlaufsform zu Ulzerationen der Haut und sterilen Abszessen. Es ist gehäuft mit einem zu Rezidiven neigenden Inflammationsverlauf zu rechnen. Ätiologisch werden autoallergische Reaktionen auf Milch- oder Fettkomponenten und immunologische Assoziationen zu Erythema nodosum und lymphozytärer Alveolitis diskutiert.
Spezifische granulomatöse Brustentzündung
Spezifische granulomatöse Brustentzündungen kommen in Industrieländern nur vereinzelt vor (▶ Tab. 5). Differenzialdiagnostisch ist die Abgrenzung von klinisch ähnlichen Verlaufsformen mit Epitheloidzellproliferationen und Riesenzellen erforderlich. Aufgrund der Heterogenität der Ursachen muss sowohl hinsichtlich des Entzündungsverlaufs und der Behandlung als auch bezüglich der Prognose stets die verursachende Grunderkrankung berücksichtigt werden. Die Kortikosteroidtherapie ist dabei explizit für die systemischen (non-malignen) Erkrankungsformen nicht verzichtbar.
Idiopathische granulomatöse Mastitis
Unter der Kategorie der idiopathischen granulomatösen Mastitis sind all jene Verläufe von zu Granulomen führenden Brustentzündungen zu subsumieren, welche im Ausschlussverfahren keiner anderen bekannten Ursache eines klinisch entsprechenden inflammatorischen Krankheitsbilds zugeordnet werden können.
![Tab. 5 Tab. 5: Grundlagen der spezifischen granulomatösen Mastitis [24].](https://gyne.de/wp-content/uploads/sites/2/2025/08/Tab.-5.jpg)
Therapie? – The jury‘s still out!
Die Behandlungsansätze der granulomatösen Mastitis folgen bisher keinem einheitlichen Behandlungspfad. In Ermangelung von Erkenntnissen aus randomisiert kontrollierten Studien müssen die Therapiekonzepte anhand klinischer Empirie gepaart mit wissenschaftlichen Daten aus Fallserien und retrospektiven Analysen abgeleitet werden. So kommen pharmakologische bzw. additiv/alternativ chirurgische Optionen unter den Prämissen ihres limitierten Level of Evidence und ihres begrenzten Empfehlungsgrads zum Einsatz.
Antibiotika
Da das initiale klinische Bild alle Zeichen einer infektiologisch (bakteriologisch) verursachten Brustentzündung aufweist, erhalten viele Patientinnen zu Beginn der Therapiekaskade eine antiinfektiöse Behandlung in Form einer kalkulierten Antibiose (ohne Abwarten eines mikrobiologischen Keimnachweises). Der abakterielle Erkrankungscharakter der granulomatösen Mastitis erklärt dabei die hohe Versagensrate der Therapie.
Kortikosteroide systemisch
Dies umfasst die hochdosiert-nachhaltige systemische Kortikosteroidbehandlung (Methylprednisolon per os, 2 × 30 mg/d bzw. 1 mg/kg/d, > 6–8 Wochen und < 6 Monate; Cave: Nebenwirkungen: Gewichtszunahme, Hyperglykämie, Cushing-Syndrom), gegebenenfalls in Kombination mit topisch angewendeter Hydrokortisonemulsion (0,5 %). Alternativ werden lower-dose Prednisolon 2 × 16 mg/d für zwei Wochen und ein Ausschleichen über zwei Monate vorgeschlagen [9, 10].
Kortikosteroide lokal
Als nebenwirkungsarme oder -freie Alternative kann die (zusätzliche) topische Lokalbehandlung der Entzündungsareale mit Hydrokortisonbutyrat-Creme 0,1 % (zweimal täglich) oder Hydrokortisonacetat-Creme 0,5 % (einmal täglich) die milden Entzündungsbeschwerden (unter anderem lokale Brustschwellung) in ihrer Prävalenz halbieren. Der Behandlungserfolg sämtlicher kortikosteroidbasierter Therapien hängt maßgeblich von der nachhaltigen Behandlungsbereitschaft der Patientin ab, vor allem kontinuierlich reduzierte steroidale Erhaltungstherapie beziehungsweise Ausschleichen und sorgfältige Kontrolle. Zum Erreichen einer Komplettremission ist prospektiv ein Behandlungszeitraum von zwei bis sechs Monaten ins Auge zu fassen. In Einzelfällen können bis zu elf Monate nötig sein.
Analgetika
Symptomatisch ist es in den meisten Fällen angezeigt, medikamentös auf ausreichende Schmerzfreiheit der Patientin hinzuwirken (unter anderem Nichtsteroidale Antirheumatika [non-steroidal anti-inflammatory drugs, NSAID]). Nur so lässt sich eine langfristige Bereitschaft zur pharmakologischen Therapie erreichen.
Methotrexat
Bei fehlendem oder unzureichendem Therapieerfolg, bei Rezidiven und zur Begrenzung langfristiger Kortikosteroidnebenwirkungen kann alternativ – und bei Bedarf additiv – zu Kortikoiden eine Behandlung mit Methotrexat (MTX) erwogen werden. Analog zur rheumatoiden Arthritis werden wöchentlich 7,5–25 mg p. o. über einen Zeitraum von 12–24 Monaten als effektiv angesehen [13, 14]. Unerwünschte Therapiefolgen sind ulzerierende Stomatitis, Leukopenie, abdominale Beschwerden, Übelkeit, Fatigue, Schüttelfrost/Fieber, Schwindelgefühl und erhöhte Infektanfälligkeit.
Immunmodulatoren
Alternativ sind Behandlungsversuche mit Colchicin beschrieben. Immuntherapien (IL-1-Rezeptor-Inhibitoren) sind derzeit in der klinischen Routine nicht als gebräuchlich anzusehen [12].
Chirurgie
Unter Kortikosteroiden erleben etwa 40 % der Patientinnen die pharmakologisch typischen Nebenwirkungen, ein Rezidiv oder ein Fortbestehen ihrer Symptome. Für diese steht therapeutisch neben der immunsuppressiven Behandlung die Kombination mit chirurgischen Eingriffen zur Verfügung [30]. Studiendaten, welche Abszessdrainagen oder -spaltungen, Herd- und Fistelexzisionen (wide local excision – WLE) bzw. als ultima ratio die Mastektomie therapeutisch inkludieren, weisen auf eine signifikante Behandlungserfolgssteigerung bezüglich der Rezidivrate und der Verkürzung der Rekonvaleszenzdauer (sechs Monate unter konservativem Regime gegenüber einem Monat nach Chirurgie; p < 0,009) hin [31]. So ergeben sich fundierte Anhaltspunkte dafür, die Lumpektomie einer granulomatösen Inflammation der Brust auch als primäre Therapieoption mit kurativer Ausrichtung anzusehen [5].
![Tab. 6 Tab. 6: Therapieerfolgsraten bei granulomatöser Brustentzündung [11,15,25–29,32].](https://gyne.de/wp-content/uploads/sites/2/2025/08/Tab.-6.jpg)
Multimodalität – mit und nicht ohne
Um die Effektivität der einzelnen Behandlungsoptionen einer granulomatösen Mastitis zu optimieren, ergibt sich aus deren Verknüpfung die wirksamste Option (▶ Abb. 2). Der modulare Therapieansatz führt dabei nicht nur zu stufenweise steigenden Erfolgsaussichten, sondern verbessert durch die Optimierung der Nebenwirkungskontrolle auch die Patientinnencompliance. Meist wird daher mit konservativen Maßnahmen begonnen, um bei Bedarf chirurgisch (in der Regel WLE) zu eskalieren. Die Häufigkeit der klinischen Anwendung diverser Kombinationen unterscheidet sich allerdings um ein Mehrfaches:
- kalkulierte Antibiose + systemische ± lokale Kortikosteroidtherapie (33–97 %)
- kalkulierte Antibiose + systemische ± lokale Kortikosteroidtherapie Abszessdrainage oder (exzidierende) Brust-/Fistelchirurgie (6–38 %)
Für die prognostische Einschätzung des meist chronischen Verlaufs der granulomatösen Mastitis sind neben den kurzfristigen Therapieerfolgen auch die mit der Erkrankung verbundenen Rezidivraten entscheidend (▶ Tab. 6) [15, 16].
Fazit für die Praxis
Zu Brustentzündungen kommt es überwiegend infektiologisch. Hiervon sind in einem Viertel der Fälle abakterielle Verlaufsformen zu unterscheiden. Ein Inflammationsverlauf mit Granulombildung ist dabei allerdings nur selten (2 %) zu beobachten. Diese chronisch verlaufende Mastitisform, klinisch meist nur im Ausschlussverfahren zu vermuten, kann letztlich nur durch die histopathologische Untersuchung einer Gewebeprobe zuverlässig bestätigt werden.
Pathogenetisch ist vorwiegend eine autoimmunologisch bedingte Fremdkörperreaktion als ursächlich anzusehen. Die erschwerte diagnostische Abgrenzung zu alternativen (nicht-)entzündlichen Krankheitsbildern der weiblichen Brustdrüse bedingt in der Regel rezidivierend-protrahierte und für die Patientin besonders belastende chronische Verläufe. Therapeutisch ist die Evidenz diverser Ansätze der Immunmodulation bei hartnäckigem, rezidivierendem und durch Abszesse und Fisteln kompliziertem Verlauf bisher begrenzt. So wird bei dieser Form chronischer Brustentzündungen die Kombination medikamentöser und chirurgischer Interventionen (Abszessdrainage/-spaltung, Herd-/Fistelexzision) zum Teil des mehrstufig-eskalierenden Behandlungskonzepts. Der Balance zwischen den verschiedenen Therapieoptionen kommt dabei besondere Bedeutung zu: es gilt, neben einem nachhaltigen Behandlungserfolg auch alle unerwünschten chirurgischen (wie multiple Narbenbildung, zunehmender Brustgewebeverlust oder -asymmetrie, Wundheilungsstörung, zukünftige Stillprobleme) und pharmakologischen Auswirkungen (insbesondere Kortikosteroidnebenwirkungen) sorgfältig abzuwägen und therapiestrategisch zu berücksichtigen.
Literatur
- Strauss A, Sanders L, Strauss C. Entzündliche Erkrankungen der weiblichen Brust. Gynäkologe 2014; 47: 111–123
- World Health Organization (WHO). Mastitis causes and management. 2000. (https://go.sn.pub/v24T6W). Zugegriffen: 04.07.2025
- Kessler E, Wolloch Y. Granulomatous mastitis: a lesion clinically simulating carcinoma. Am J Clin Pathol 1972; 58(6): 642–646
- Fehm T, Rody A, Hadji P, Solomayer EF. Referenz Gynäkologie. Thieme Verlag Stuttgart; 2021
- Moris D, Damaskos C, Davakis S et al. Is idiopathic granulomatous mastitis a surgical disease? The jury is still out. Ann Transl Med 2017; 5(15): 309
- Strauss A. Entzündliche Brusterkrankungen. In: Ultraschallpraxis in der Geburtshilfe und Gynäkologie. 3. Auflage. Springer Verlag, Heidelberg; 2017
- Neubacher M, Pruss M, Fehm T, Krawczyk N. Eine gerötete Brust. Gynäkologie 2023; 56: 135–138
- Centers for Disease Control and Prevention. Idiopathic granulomatous mastitis in Hispanic women – Indiana, 2006–2008. MMWR Morb Mortal Wkly Rep 2009; 58: 1317–1321
- DeHertogh DA, Rossof AH, Harris AA, Economou SG. Prednisone management of granulomatous mastitis. N Engl J Med 1980; 303: 799–800
- Freeman CM, Xia BT, Wilson GC et al. Idiopathic granulomatous mastitis: a diagnostic and therapeutic challenge. Am J Surg 2017; 214: 701–706
- Altintoprak F, Kivilcim T, Yalkin O et al. Topical steroids are effective in the treatment of idiopathic granulomatous mastitis. World J Surg 2015; 39(11): 2718–2723
- Wolfrum A, Kümmel S, Theuerkauf I et al. Granulomatous mastitis: a therapeutic and diagnostic challenge. Breast Care 2018; 13: 413–418
- Kim J, Tymms KE, Buckingham JM. Methotrexate in the management of granulomatous mastitis. ANZ J Surg 2003; 73: 247–249
- Akbulut S, Arikanoglu Z, Senol A et al. Is methotrexate an acceptable treatment in the management of idiopathic granulomatous mastitis? Arch Gynecol Obstet 2011; 284(5): 1189–1195
- Lei X, Chen K, Zhu L et al. Treatments for idiopathic granulomatous mastitis: systematic review and meta-analysis. Breastfeed Med 2017; 12(7): 415–421
- Wang C, Lin Y, Zhou Y, Sun Q. Novel paradigm for treating idiopathic granulomatous mastitis. J Invest Surg 2021; 34(7): 816–817
- Marchant DJ. Inflammation of the breast. Obstet Gynecol Clin North Am 2002; 29(1): 89–102
- Strauss A, Günther V, Freytag D et al. Gutartige Veränderungen der weiblichen Brust. Gynäkologe 2013; 46: 925–940
- Hance KW, Anderson WF, Devesa SS et al. Trends in inflammatory breast carcinoma incidence and survival: the surveillance, epidemiology, and end results program at the National Cancer Institute. J Natl Cancer Inst 2005; 97(13): 966–975
- S3-Leitlinie Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms. AWMF Leitlinien-Register 032/045 Version 4.3 2017
- Schad K, Cozzio A. Paraneoplasien. In: Derma Net online. BBS Hrsg. Schöfer H, Baur-Beger S. Verlag Wiesbaden; 2014
- Lee KW, Chung SY, Yang I et al. Inflammatory breast cancer: imaging findings. Clin Imaging 2005; 29(1): 22–25
- Peters F. Die nonpuerperale Mastitis. Gynäkologe 2001; 34: 930–939
- Friedrich M, Diedrich K. Granulomatöse Mastitis. Gynäkologe 2004; 37: 169–170
- Ma X, Min X, Yao C. Different treatments for granulomatous lobular mastitis: a systematic review and meta-analysis. Breast Care 2020; 15(1): 60–66
- Hur SM, Cho DH, Lee SK et al. Experience of treatment of patients with granulomatous lobular mastitis. J Korean Surg Soc 2013; 85(1): 1–6
- Li S, Huang Q, Song P et al. Clinical characteristics and therapeutic strategy of granulomatous mastitis accompanied by Corynebacterium kroppenstedtii: a retrospective cohort study. BMC Womens Health 2023; 23(1): 388
- Çetin K, Sıkar HE, Göret NE et al. Comparison of topical, systemic, and combined therapy with steroids on idiopathic granulomatous mastitis: a prospective randomized study. World J Surg 2019; 43(11): 2865–2873
- Zhang Q, Zhang W, Lv J et al. The effect of local steroid administration on idiopathic granulomatous mastitis: a systematic review and meta-analysis. J Surg Res 2023; 295: 511–521
- Karanlik H, Ozgur I, Simsek S et al. Can steroids plus surgery become a first-line treatment of idiopathic granulomatous mastitis? Breast Care 2014; 9: 338–342
- Yabanoglu H, Çolakoglu T, Belli S et al. A comparative study of conservative versus surgical treatment protocols for 77 patients with idiopathic granulomatous mastitis. Breast J 2015; 21: 363–371
- Sakurai K, Fujisaki S, Enomoto K et al. Evaluation of follow-up strategies for corticosteroid therapy of idiopathic granulomatous mastitis. Surg Today 2011; 41: 333–337
Autor:
Univ.-Prof. Dr. med. Alexander Strauss
Christian-Albrechts-Universität zu Kiel
Christian-Albrechts-Platz 4, 24118 Kiel
astrauss@email.uni-kiel.de