Die Behandlung des Endometriumkarzinoms hat in den vergangenen Jahren große Veränderungen mit sich gebracht. Die jüngsten Ergebnisse bzgl. prognostischer Unterschiede zwischen NSMP high-grade und low-grade Karzinomen zeigen, wie dynamisch die Forschung und klinische Anwendung zurzeit ist. Frühe Endometriumkarzinome benötigen heutzutage in der Regel keine systematische Lymphonodektomie mehr, sondern können mit einer pelvinen Sentinelbiopsie onkologisch sicher und zugleich morbiditätsreduziert behandelt werden. Durch die molekulare Diagnostik hat sich auch die prognostische Genauigkeit deutlich verbessert, was bereits jetzt großen Einfluss auf die Empfehlung zur adjuvanten Therapie nimmt. Die aktuellen Behandlungsoptionen beim primär fortgeschrittenen Endometriumkarzinom sind vielfältiger geworden und erstrecken sich über die operative Resektion und Chemotherapie über die Anwendung verschiedener Immuncheckpointinhibitoren bis hin zur Kombination mit Olaparib. Diese neuen Systemtherapeutika haben eine deutliche Überlebensverbesserung für unsere Patientinnen mit sich gebracht. In Zukunft wird sowohl eine weitere Anpassung der adjuvanten Therapie an die molekularen Risikoprofile als auch viele neue Erkenntnisse und Zulassungen von bisher wenig oder nicht bekannten Medikamenten erwartet.
Einleitung
Die starke Zunahme der Komplexität in Diagnostik und Therapie von Endometriumkarzinomen der letzten Jahre erfordert neben viel detailliertem Wissen und technisch-operativem Können auch die ständige Aktualisierung von beidem. Der folgende Artikel dient daher dem Überblick über neueste Entwicklungen und Erkenntnisse in der gynäkologisch-onkologischen Behandlung aller Endometriumkarzinome.
Molekulare Subgruppenbestimmung als Schlüssel
Es ist inzwischen allgemein bekannt, dass die Bestimmung der molekularen Subgruppe bei Endometriumkarzinomen prognostisch in höchstem Maße relevant ist. Aktuell wird dies auch in der Therapie immer wichtiger. Daher sollte die Bestimmung der Subgruppe bereits am Abradat und nicht erst nach erfolgter Hysterektomie erfolgen, damit zum Zeitpunkt der operativen Therapie bereits möglichst viel über die molekularen Risikofaktoren des Karzinoms bekannt ist.
Bei Erstdiagnose eines Endometriumkarzinoms sollte der Status der „mismatch-repair-Proteine” (MMR) immunhistochemisch bestimmt werden, wonach die Tumoren in MMR-defizient (MMRd) und non-MMRd eingeteilt werden können. Der häufig verwendete Begriff „MMR-profizient“ (MMRp) sollte dabei nicht mehr verwendet werden, da es sich bei non-MMRd Tumoren um eine sehr heterogene Gruppe handelt, die nicht als eine spezifische molekulare Subgruppe definiert ist [1].
Diese Einteilung ist nicht nur im Hinblick auf Prognose und Therapie relevant, sondern erlaubt auch Rückschlüsse auf das individuelle genetische Risiko der Patientin. Einige der Patientinnen, die ein MMRd-Endometriumkarzinom haben, haben eine Keimbahnmutation mit Mikrosatelliteninstabilität, das so genannte Lynch-Syndrom. Auch wenn dies nur wenige Patientinnen (1–3 %) betrifft, ist es doch klinisch hochrelevant [2, 3]. Da mit Vorliegen des Lynch-Syndroms auch das Risiko für andere Krebsentitäten sowie das familiäre Risiko ansteigen, sollten Patientinnen mit einem entsprechenden immunhistochemischen Tumorprofil eine humangenetische Beratung in Anspruch nehmen.
Etablierte molekulare Risikogruppen und ihre klinische Bedeutung
Neben der Subgruppe der MMRd-Endometriumkarzinome gibt es die Hochrisikogruppe der p53-aberranten Endometriumkarzinome und die im Gegensatz dazu Niedrigrisikogruppe der POLE-mutierten Tumoren, die sich durch eine sehr hohe Tumormutationslast und gleichzeitig exzellente Prognose auszeichnen. Dabei ist kennzeichnend, dass es sich bei p53-Aberranz sowohl um eine Überexpression als auch um fehlende Expression handeln kann. Die übrigen Endometriumkarzinome werden zum aktuellen Zeitpunkt in der Gruppe der „Tumoren ohne spezifisches molekulares Profil“ (No Specific Molecular Profile, NSMP) zusammengefasst [4].
Diese, in den vergangenen Jahren fest etablierten, Risikogruppen sind zwar nicht vollständig unabhängig von der anatomischen Ausbreitung des Karzinoms zu sehen, für eine adäquate klinische Risikobeurteilung sind jedoch beide Faktoren gleichzeitig zu beurteilen. Mit der Aktualisierung der FIGO-Klassifikation sollen unter anderem diese beiden wichtigen prognostische Kriterien – also anatomische Ausbreitung und molekulare Subgruppen – zusammengeführt werden, um die Prognose genauer abzubilden. Das Endometriumkarzinom ist die erste gynäko-onkologische Tumorentität, bei der nicht mehr ausschließlich die anatomische Ausbreitung für das FIGO-Staging einbezogen wird, sondern auch die molekulare Subgruppe [5].
Zuletzt ist auch erneut die wichtige prognostische Bedeutung der Östrogenrezeptoren deutlich geworden. Endometriumkarzinome der NSMP-Gruppe, die Östrogenrezeptor-negativ sind, haben eine signifikant schlechtere Prognose als solche, die eine positive Expression von Östrogenrezeptoren zeigen [6, 7]. Darüber hinaus führen auch high-grade Karzinome in der NSMP-Gruppe zu einer deutlich schlechteren Prognose als low-grade Karzinomen [6–8].
Integration molekularer Marker in FIGO-Klassifikation und aktuelle Leitlinien
Die 2025 auf dem Jahreskongress der europäischen Gesellschaft für gynäkologische Onkologie (ESGO) präsentierten europäischen Leitlinien zur Diagnostik und Therapie des Endometriumkarzinoms fassen diese Erkenntnisse zusammen. Es sind, wie auch schon in vorherigen Publikationen, vier verschiedene Risikogruppen definiert. Dank der neuen FIGO-Klassifikation ist nun die Einteilung in Bezug auf anatomische Ausbreitung und molekulare Subgruppe zugleich möglich (▶ Tab. 1).
Sentinel-Lymphknotenbiopsie und operative Standards
Während es vor wenigen Jahren noch üblich war, die myometrane Infiltrationstiefe des Endometriumkarzinoms intraoperativ per Schnellschnitt bestimmen zu lassen, sprechen sich die aktuellen europäischen Leitlinien gegen diese Form von Bestimmung der Infiltrationstiefe aus. Zusätzlich erfordert die histopathologische Aufarbeitung der Sentinel-Lymphknoten ein Ultrastaging, kann also ebenfalls nicht per Schnellschnitt erfolgen. Der Schnellschnitt spielt beim Endometriumkarzinom folglich insgesamt nur noch eine untergeordnete Rolle, kann aber insbesondere bei fortgeschrittenen Befunden oder unklarer Tumorausdehnung intraoperativ weiterhin von Bedeutung sein.
Auch die systematische pelvine und paraaortale Lymphonodektomie wird seit der Einführung der bilateralen pelvinen Sentinel-Biopsie (SNB) entsprechend der neuen ESGO Leitlinie zunehmend durch die SNB ersetzt, da Letztere eine hohe onkologische Sicherheit aufweist. Klinische Studien zeigen, dass das Gesamtüberleben nach SNB im Vergleich zur systematischen Lymphonodektomie nicht verringert ist. Weiterhin unklar bleibt hingegen die prognostische Bedeutung von isolierten Tumorzellen in Lymphknoten. Hierzu läuft aktuell eine klinische Studie, deren Ergebnisse 2029 erwartet werden (ENDO-ITC study, NCT06689956). Während die therapeutische Wirkung der Lymphonodektomie als fragwürdig diskutiert wird, ist die deutlich höhere Morbidität durch diesen Eingriff im Vergleich zur SNB unumstritten [9–11].
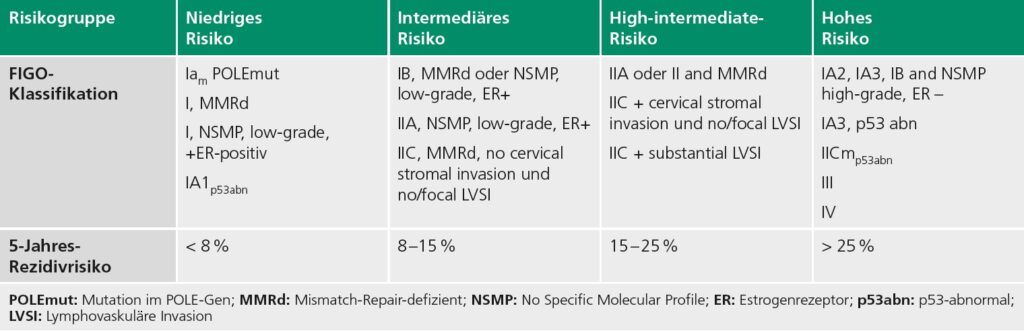
Die Markierung des Sentinellymphknotens erfolgt standardmäßig mit 2–4 ml Indocyaningrün (ICG) als zervikale Injektion. Anschließend kann der, bzw. die Lymphknoten mit einer entsprechenden Kamera auch laparoskopisch dargestellt werden kann (▶ Abb. 1) [12]. Im Vergleich zur herkömmlichen Markierung mit Technetium oder Patentblau bietet diese Technik eine sehr hohe Sensitivität von bis zu 98 % sowie eine Detektionsrate von über 95 % [13, 14].
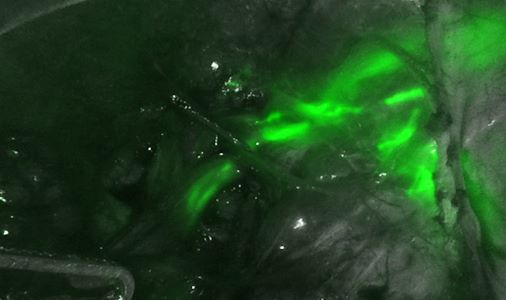
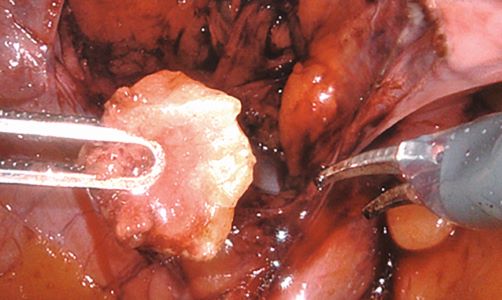
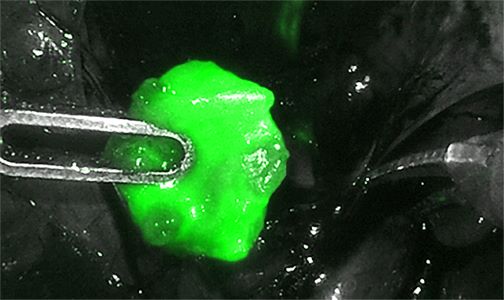
Primär fortgeschrittenes oder rezidivierendes Endometriumkarzinom
Grundsätzlich sollten auch Patientinnen mit primär fortgeschrittenem Endometriumkarzinom eine operative Tumorresektion erhalten, sofern eine makroskopisch tumorfreie Resektion möglich erscheint. Dies kann gegebenenfalls auch multiviszerale Eingriffe notwendig machen und sollte daher an einem entsprechenden Zentrum durchgeführt werden.
Analog zum Ovarialkarzinom sollte keine systematische Lymphonodektomie erfolgen, sondern Lymphknoten nur im Falle makroskopischer Auffälligkeiten intraoperativ entfernt werden.
Bei lokal fortgeschrittenen Befunden, die nicht primär resektabel sind, kann eine definitive Radiotherapie erwogen werden. In Einzelfällen ist dies auch als neoadjuvantes Konzept möglich. Postoperativ oder primär, sofern keine operative Resektion erfolgen kann, ist in aller Regel eine Systemtherapie empfohlen.
Systemtherapie
In jüngerer Zeit hat die Einführung molekularer Subgruppen und neuer Behandlungsmethoden, insbesondere der Immuntherapie, zu einem grundlegenden Paradigmenwechsel in der systemischen Therapie des Endometriumkarzinoms geführt. Davon profitieren vor allem Patientinnen mit primär fortgeschrittenem oder rezidiviertem Tumor, die zuvor eine besonders schlechte Prognose hatten [15].
Immuncheckpointinhibitoren
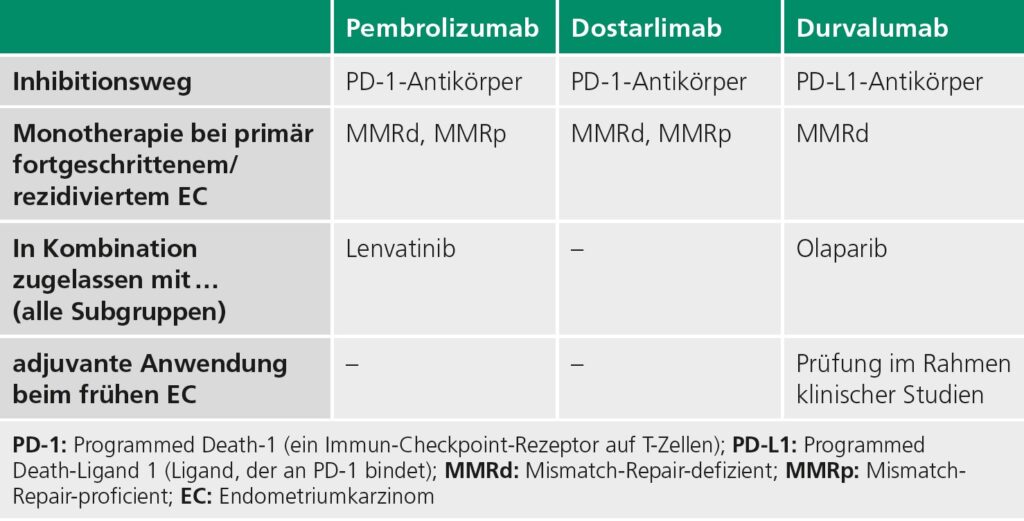
Die Hinzunahme von Immuncheckpointinhibitoren (ICi) zur platinbasierten Chemotherapie (üblicherweise sechs Zyklen Carboplatin AUC 5 + Paclitaxel 175 mg/m2 KOF q3w) hat sich in der fortgeschrittenen, rezidivierten und metastasierten Erkrankungssituation – in der ein messbarer Tumor ggf. auch postoperativ besteht (also „First-Line-Therapie“) – zum neuen Standard entwickelt. Davon zu unterscheiden ist die fortgeschrittene Primärsituation in der postoperativ Tumorfreiheit besteht, also die adjuvante Situation. Durch die Hinzunahme von ICi wurden auch chemotherapiefreie Erhaltungstherapien zugelassen, die kontinuierliche Therapien mit gutem Ansprechen und guter Therapieverträglichkeit ermöglichen.
Aktuelle Studiendaten und Zulassungen für Immuntherapien
In diesem Zusammenhang wurden in der letzten Zeit drei positive Phase III Studien publiziert, die zu Zulassungen geführt haben. So konnte der internationale RUBY-Trial zeigen, dass sowohl Patientinnen mit fortgeschrittenen MMRd-Endometriumkarzinomen als auch Patientinnen mit non-MMRd-Endometriumkarzinomen von zusätzlich zur Chemotherapie gegebenem Dostarlimab (PD1-Inhibitor) deutlich profitieren. In der Gesamtstudienpopulation betrug das progressionsfreie Überleben nach 24 Monaten 36,1 % in der Gruppe, die Dostarlimab erhielt, im Vergleich zu 18,1 % in der Placebogruppe. Auch das Gesamtüberleben in der Gesamtgruppe nach 24 Monaten war mit 71,3 % in der Interventionsgruppe (Dostarlimab) deutlich größer als das der Placebogruppe (56 %) [16].
Als zweite klinisch relevante Studie im aktuellen Kontext ist die Keynote 868 zu nennen. Hier wurde ebenfalls in der „First-Line“-Situation die Hinzunahme von Pembrolizumab zur Standardchemotherapie geprüft, unabhängig vom molekularen Subgruppenprofil. Es zeigte sich ein signifikant verlängertes progressionsfreies Überleben im Vergleich zur alleinigen Chemotherapie [17]. Dies konnte für zwei unabhängige Kohorten, für MMRD und für non-MMRd, gezeigt werden.
Basierend auf diesen Daten ist Dostarlimab in Kombination mit einer platinbasierten Chemotherapie für Patientinnen mit rezidiviertem oder primär fortgeschrittenem, chemotherapie-naivem Endometriumkarzinom zugelassen – und zwar unabhängig von der molekularen Subgruppe [18]. 2024 ist zudem Pembrolizumab zur Behandlung von primär fortgeschrittenen oder rezidivierenden Endometriumkarzinomen, unabhängig vom MMR-Status, zugelassen worden.
Die dritte Studie, die DUO-E Studie, prüfte die Kombination von Durvalumab (PD-L1-Inhibitor) mit PARP-Inhibition (Olaparib) in einem dreiarmigen Setting. So konnte für die MMRd Gruppe ein Vorteil für den ICi gezeigt werden, die Hinzunahme des PARPi erbrachte in dieser Gruppe keinen weiteren Vorteil. Allerdings zeigt die Gruppe non-MMRd ein weiter verbessertes PFS für die Dreifachkombi (CTX + ICi +PARPi) [19]. Diese du ale Kombination ist daher zugelassen für die Behandlung von fortgeschrittenen MMRd-Endometriumkarzinomen, und die dreifache Kombination für die non-MMRd Gruppe.
In der „Second Line“ sind aufgrund positiver Phase II Studien Pembrolizumab oder Dostarlimab für MMRd und die Kombination aus Pembrolizumab und Lenvatinib (unabhängig vom Subtyp des Endometriumkarzinoms) zugelassen. Im klinischen Alltag sollte, neben der üblichen Überwachung bei der Gabe von Immuncheckpointinhibitoren bei der Gabe von Lenvatinib ein besonderes Augenmerk auf arterielle Hypertonien, Diarrhoen und pathologische QT-Zeit-Verlängerungen gelegt werden, die stationäre Behandlungen mit Dosisreduktion oder Absetzen der Medikation notwendig machen können [20]. Eine zusammenfassende Übersicht zu aktuell zugelassenen Immuntherapien ist in ▶ Tabelle 2 dargestellt.
Für die Praxis
Insbesondere in fortgeschrittenen Therapielinien, bei p53-aberranten und/oder serösen Endometriumkarzinomen, ist die Bestimmung des HER2-neu-Rezeptors sinnvoll, um gegebenenfalls eine Kostenübernahme für Trastuzumab oder auch Trastuzumab-Deruxtecan zu erwirken. Weiterhin bleibt auch die hormonelle Therapie – wenn auch in Bezug auf Tumorkontrolle und Überleben eine weniger effektive Therapie als die in den vorangegangenen Abschnitten genannten – eine Option. Dies gilt für Patientinnen mit fortgeschrittenen, hormonrezeptorpositiven Endometriumkarzinomen, insbesondere dann, wenn eine Chemo- und/oder Immuntherapie nicht möglich ist.
Ausblick
Derzeit befindet sich unter anderem der RAINBO-Trial (NCT05255653), bei welchem adjuvante Therapien in Abhängigkeit von der molekularen Subgruppe analysiert werden, in klinischer Prüfung. So ist unter anderem ein Studienarm (RAINBO Red, NCT 05255653–1) dafür bestimmt, die adjuvante Anwendung von Olaparib zusätzlich zur kombinierten Chemotherapie + Radiotherapie (external beam radiotherapie, EBRT) zu prüfen. Im RAINBO Green Studienarm ist die adjuvante Anwendung von ICi (Durvalumab) + EBRT ohne zusätzliche Applikation von Chemotherapie vs. EBRT +/- Chemotherapie bei MMRd-Endometriumkarzinomen Gegenstand der klinischen Prüfung (RAINBO Green trial, NCT 05255653–2). Weiterhin prüft eine Phase II-Studie zurzeit die Anwendung von Sacituzumab-Govitecan bei fortgeschrittenen bzw. rezidivierten Endometriumkarzinomen (NCT04251416).
Gegenstand zukünftiger Untersuchungen wird auch die Anwendung von Immuncheckpointinhibitoren nach bereits erfolgter Immuncheckpointinhibition sein, deren Wirkung und Anwendung zum jetzigen Zeitpunkt noch unklar ist. Insbesondere mit einer Anwendung von ICi in früheren (adjuvanten) Therapielinien wird diese Kombination von ICis in Zukunft immer bedeutsamer werden.
Literatur
- Concin N, Nout R, Matias-Guiu X et al. ESGO-ESTRO-ESP Guidelines on the management of endometrial carcinoma – Update 2025
- Singh S, Resnick KE. Lynch syndrome and endometrial cancer. South Med J 2017; 110: 265–269
- Ryan N, Lennie KA, Naskretski A et al. Mismatch in testing: a retrospective analysis of mismatch repair testing in endometrial cancer and Lynch syndrome diagnosis in multiple specialist centres in the UK and Ireland (March 2022-March 2023). BMJ Oncol 2025; 4: e000688
- Langer T. S3-Leitlinie Endometriumkarzinom Langversion. 2022: 373
- Berek JS, Matias-Guiu X, Creutzberg C et al. FIGO staging of endometrial cancer: 2023. J Gynecol Oncol 2023; 34: e85
- Jamieson A, Huvila J, Chiu D et al. Grade and estrogen receptor expression identify a subset of no specific molecular profile endometrial carcinomas at a very low risk of disease-specific death. Mod Pathol 2023; 36: 100085
- Vermij L, Jobsen JJ, León-Castillo A et al. Prognostic refinement of NSMP high-risk endometrial cancers using oestrogen receptor immunohistochemistry. Br J Cancer 2023; 128: 1360–1368
- Jamieson A, Huvila J, Chiu D et al. Corrigendum to „Grade and Estrogen Receptor Expression Identify a Subset of No Specific Molecular Profile Endometrial Carcinomas at a Very Low Risk of Disease-Specific Death“: [Modern Pathology 36 (2023) 100085]. Mod Pathol 2023; 36: 100212
- Ignatov A, Papathemelis T, Ivros S et al. Comparison of survival of patients with endometrial cancer undergoing sentinel node biopsy alone or systematic lymphadenectomy. Arch Gynecol Obstet 2020; 302: 995–1000
- Ignatov A, Ivros S, Bozukova M et al. Systematic lymphadenectomy in early stage endometrial cancer. Arch Gynecol Obstet 2020; 302: 231–239
- Abu-Rustum NR, Alektiar K, Iasonos A et al. The incidence of symptomatic lower-extremity lymphedema following treatment of uterine corpus malignancies: a 12-year experience at Memorial Sloan-Kettering Cancer Center. Gynecol Oncol 2006; 103: 714–718
- Mauro J, Raimondo D, Di Martino G et al. Assessment of sentinel lymph node mapping with different volumes of indocyanine green in early-stage endometrial cancer: the ALIEN study. Int J Gynecol Cancer 2024; 34: 824–829
- Rossi EC, Kowalski DL, Scalici J et al. A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): a multicentre, prospective, cohort study. Lancet Oncol 2017; 18: 384–392
- Persson J, Salehi S, Bollino M et al. Pelvic sentinel lymph node detection in high-risk endometrial cancer (SHREC-trial)—the final step towards a paradigm shift in surgical staging. Eur J Cancer 2019; 116: 77–85
- Robert Koch Institut. Krebs in Deutschland. 3.20 Gebärmutterkörper. RKI 2015
- Mirza MR, Chase DM, Slomovitz BM et al. Dostarlimab for primary advanced or recurrent endometrial cancer. N Engl J Med 2023; 388: 2145–2158
- Eskander RN, Sill MW, Beffa L et al. Pembrolizumab plus chemotherapy in advanced endometrial cancer. N Engl J Med 2023; 388: 2159–2170
- JEMPERLI 500 mg Konzentrat zur Herstellung einer Infusionslösung. Packungsbeilage. Hersteller: GlaxoSmithKline. 2025
- Westin SN, Moore K, Chon HS et al. Durvalumab plus carboplatin/paclitaxel followed by maintenance durvalumab with or without olaparib as first-line treatment for advanced endometrial cancer: the Phase III DUO-E Trial. J Clin Oncol 2024; 42: 283–299
- Lenvima® 4 mg/10 mg Hartkapseln. Packungsbeilage. Hersteller: Eisai Co., Ltd. 2025
Interessenskonflikte:
Die Autorin und der Autor erklären, dass keine Interessenkonflikte im Sinne der Empfehlungen des International Committee of Medical Journal Editors bestanden.

Dr. med. Louisa Proppe
Klinik für Gynäkologie und Geburtshilfe
Universitätsklinikum Münster
Albert-Schweitzer-Campus 1
48149 Münster
Louisa.Proppe@ukmuenster.de
Univ.-Prof. Dr. Lars Christian Hanker
Klinik für Gynäkologie und Geburtshilfe
Universitätsklinikum Münster
Albert-Schweitzer-Campus 1
48149 Münster

Weiterlesen:




